La radiothérapie interne vectorisée contre le cancer du sein triple négatif
Publié par Nina Laurent, le 13 août 2025 1.1k
Le cancer du sein triple négatif est un sous-type de cancer du sein qui représente environ 10 à 15% des cancers du sein. Il se caractérise par l'absence de trois molécules particulières que l'on retrouve habituellement dans les autres types de cancers du sein : ceux aux hormones féminines (œstrogènes et progestérone), ainsi que la protéine HER2 (Human Epidermal Growth Factor Receptor 2). Ces molécules sont souvent utilisées comme cibles pour diverses thérapies contre le cancer du sein. Cela implique que certains traitements, efficaces pour d’autres cancers du sein, ne fonctionnent pas pour le cancer du sein triple négatif.
Ce cancer est souvent plus agressif, a tendance à se propager rapidement à d’autres parties du corps (métastases), et le risque de rechute est plus élevé que pour d’autres types de cancer du sein6. Pour le soigner, on utilise généralement une combinaison de traitements : chirurgie et radiothérapie externe pour traiter la tumeur localement, et chimiothérapie ou immunothérapie afin d’agir sur l’ensemble du corps et notamment sur les métastases. Ces traitements agissant sur l’ensemble du corps sont appelés traitements systémiques. Cependant, ce cancer peut résister à la chimiothérapie7 et toutes les patientes ne sont pas éligibles à l’immunothérapie. Les options de traitement systémique sont donc limitées.
La médecine nucléaire est une spécialité médicale qui utilise les capacités de certains atomes radioactifs pour étudier, diagnostiquer et traiter des maladies telles que le cancer. Ces atomes radioactifs, appelés radionucléides, sont capables d’expulser de l’énergie sous forme de rayonnements : c’est le phénomène de radioactivité1. Il existe plusieurs types de rayonnements, certains sont peu agressifs pour l’organisme et vont permettre d’évaluer le fonctionnement des organes (imagerie médicale), d’autres sont plus toxiques et vont permettre de détruire des cellules malades (thérapie). On va donc choisir le radionucléide en fonction de l’effet recherché et l’injecter en très petites quantités dans le corps.
A Nantes, le cyclotron Arronax permet la production d’astate, l’élément le plus rare sur terre. L’équipe d’oncologie nucléaire du CRCI2NA utilise cet astate afin de développer de nouvelles thérapies, notamment pour le cancer du sein triple négatif. Nous travaillons plus particulièrement avec l’astate-211 qui est un radionucléide émetteur de rayonnements de type α. Les rayonnements α sont des rayonnements puissants et particulièrement toxiques pour les cellules cancéreuses, qui vont donc servir en thérapie. En revanche, ils vont avoir un effet très localisé et ne vont pouvoir parcourir que quelques micromètres dans le corps, agissant à l’échelle de quelques cellules seulement. Ces caractéristiques permettent aux rayonnements α d’être particulièrement efficaces sur les cellules cancéreuses, sans dépasser et atteindre les tissus sains alentours. Si nous parvenons à amener ces rayonnements α au sein d’une tumeur, nous pouvons donc la détruire de manière efficace, sans abimer les organes à proximité.
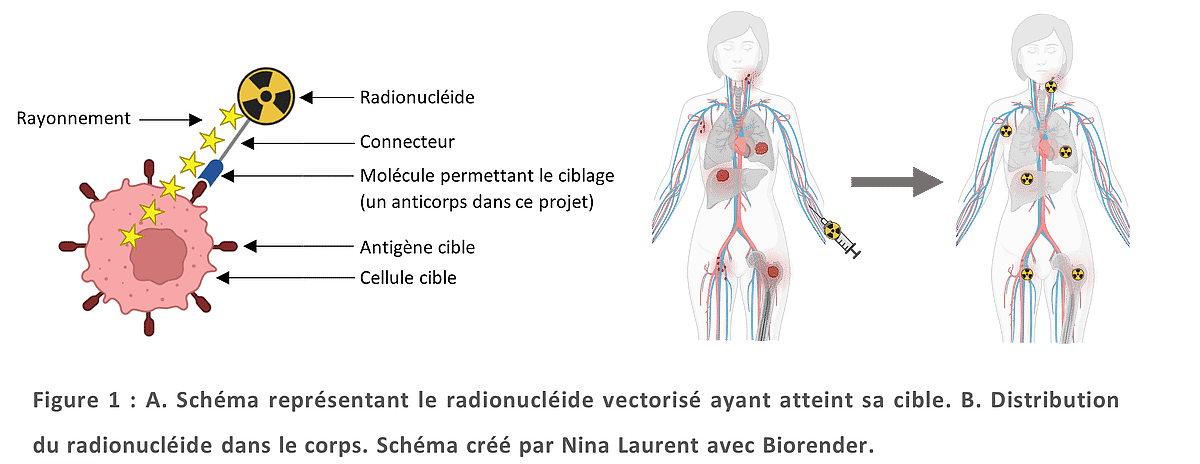
C’est ce que nous cherchons à développer grâce à la radiothérapie interne vectorisée. La radiothérapie interne vectorisée est un traitement novateur qui consiste à utiliser un radionucléide émetteur de rayonnements toxiques, et à le vectoriser, c’est-à-dire à l’attacher à une autre molécule qui permettra d’acheminer le traitement directement sur la tumeur. Pour cela, on utilise une molécule vectrice, capable de reconnaitre une cellule tumorale, comme un anticorps par exemple. Un anticorps est une molécule naturellement produite par notre corps, capable de reconnaître certaines cellules malades. En médecine, on peut aussi fabriquer ces anticorps pour leur faire transporter un traitement, ici le radionucléide, vers les cellules malades. L’anticorps va reconnaitre une cellule cancéreuse grâce à des antigènes particuliers, des molécules produites par la cellule cancéreuse et présentes à sa surface (voir Figure 1.A.). Dans ce projet, le radionucléide utilisé est l'astate-211, un émetteur de rayonnements α. On parle donc de radiothérapie interne vectorisée α ou RIVα.
Contrairement à la radiothérapie externe, la radiothérapie interne vectorisée repose sur une administration interne du traitement. Ce dernier est généralement injecté dans une veine puis circule dans tous le corps, ce qui permet de traiter simultanément plusieurs sites cancéreux. Ce type de traitement systémique est particulièrement utile dans le cas où plusieurs foyers cancéreux sont détectés, lors de cancers métastasés notamment3–5 (cf. Figure 1.B.).
Le projet de recherche présenté ici vise à tester une nouvelle méthode, la radiothérapie interne vectorisée α, en complément de la chirurgie afin de traiter le cancer du sein triple négatif. Cette approche consiste à injecter par voie sanguine une petite quantité d’astate-211 vectorisé avec un anticorps, comme vu précédemment. Ceci afin d’éliminer les cellules cancéreuses restantes après la chirurgie, que ce soit dans le sein, dans le sang ou tout autre organe où le cancer pourrait se propager, comme par exemple le poumon.
L'efficacité et la toxicité de cette thérapie ont tout d’abord été évaluées dans un modèle pré-clinique (chez la souris) dans lequel des cellules tumorales sont injectées dans le sang afin de mimer la dissémination des cellules tumorales dans l’organisme. Puis le traitement par radiothérapie interne vectorisée α est injecté. Si le traitement est efficace, il devrait parvenir à détruire les cellules tumorales préalablement injectées. Les résultats obtenus ici sont très prometteurs puisque le traitement a bien permis de détruire les cellules cancéreuses, allant jusqu'à tripler l'espérance de vie des souris et guérissant jusqu’à 36% des animaux. Cependant des phénomènes de toxicité ont été observés, notamment une perte de poids. Des études préliminaires semblent montrer une toxicité au niveau de l’estomac, ce qui pourrait expliquer les pertes de poids. D’autres études sont donc nécessaires pour mieux comprendre cette toxicité et limiter cet effet indésirable avant d’envisager une utilisation chez la femme.
Image
Visuel principal réalisé par Maëlle Laurent sur Canva.
Bibliographie
1. CEA. La radioactivité. CEA/Découvrir & Comprendre https://www.cea.fr/comprendre/... (2018).
2. Eychenne, R., Chérel, M., Haddad, F., Guérard, F. & Gestin, J.-F. Overview of the Most Promising Radionuclides for Targeted Alpha Therapy: The ‘Hopeful Eight’. Pharmaceutics 13, 906 (2021).
3. Gouard, S. et al. Targeted-Alpha-Therapy Combining Astatine-211 and anti-CD138 Antibody in a Preclinical Syngeneic Mouse Model of Multiple Myeloma Minimal Residual Disease. Cancers (Basel) 12, 2721 (2020).
4. Lugat, A. et al. Survival impact of [225Ac]Ac-DOTATOC alpha-therapy in a preclinical model of pancreatic neuroendocrine tumor liver micrometastases. Eur J Nucl Med Mol Imaging 52, 730–743 (2025).
5. Roncali, L. et al. Brain intratumoural astatine-211 radiotherapy targeting syndecan-1 leads to durable glioblastoma remission and immune memory in female mice. eBioMedicine 105, (2024).
6. Deluche, E. et al. Contemporary outcomes of metastatic breast cancer among 22,000 women from the multicentre ESME cohort 2008–2016. European Journal of Cancer 129, 60–70 (2020).
7. Nedeljkovic, M. & Damjanovic, A. Mechanisms of Chemotherapy Resistance in Triple-Negative Breast Cancer-How We Can Rise to the Challenge. Cells 8, 957 (2019).