Visualiser le sang en mouvement : voyage au cœur de l’IRM de flux 4D
Publié par Sébastien Levilly, le 3 décembre 2025 690
Une technologie encore méconnue qui pourrait transformer notre compréhension du système cardiovasculaire.
Et si on pouvait filmer le sang en train de circuler ?
Lorsque l’on évoque l’IRM, chacun visualise des images en noir et blanc, souvent statiques, montrant l’anatomie du cerveau, du genou ou du cœur. L’idée même de “filmer” ce qui se passe à l’intérieur de nos vaisseaux paraît presque futuriste. Et pourtant, cette possibilité existe déjà. Les premières techniques d’IRM de flux sont apparues à la fin des années 1980, avec la mesure de vitesse dans un seul plan : l’IRM de flux 2D. Précieuse pour quantifier le débit, cette approche restait limitée à une coupe unique, incapable de saisir la complexité réelle des mouvements du sang dans un volume. Depuis une quinzaine d’années, une modalité d’imagerie particulière, l’IRM de flux 4D, permet de capturer non seulement la forme des structures vasculaires, mais aussi la manière dont le sang s’y déplace, dans un volume tridimensionnel et au fil du temps. Autrement dit : un volume qui bouge, qui vit, et qui révèle une dimension invisible de notre organisme.
Découvrir cette technologie, c’est entrer dans un monde où les images médicales se transforment en véritables champs de données dynamiques. On peut y observer des tourbillons dans l’aorte, des écoulements rapides à proximité d’une valve cardiaque ou de subtiles variations de vitesse dans un vaisseau déformé par une maladie. Pour un œil non averti, ces images ressemblent parfois à des cartes météo du corps humain. Pour les chercheurs et les cliniciens, elles offrent une fenêtre inédite sur ce qui fait battre la vie : la circulation du sang.
Qu’est-ce que l’IRM de flux 4D ? Une carte dynamique du flux sanguin
Contrairement à l’IRM classique produisant généralement une série d’images anatomiques, l’IRM de flux 4D mesure directement la vitesse du sang en chaque point d'un volume donné. Cette mesure est répétée à différents moments du cycle cardiaque : d’où la “quatrième dimension”, le temps. En pratique, l’appareil enregistre des signaux qui dépendent des déplacements microscopiques des molécules d’eau. C’est à partir de ces signaux que l’on déduit, par des algorithmes de reconstruction, la direction et l’intensité du flux sanguin.
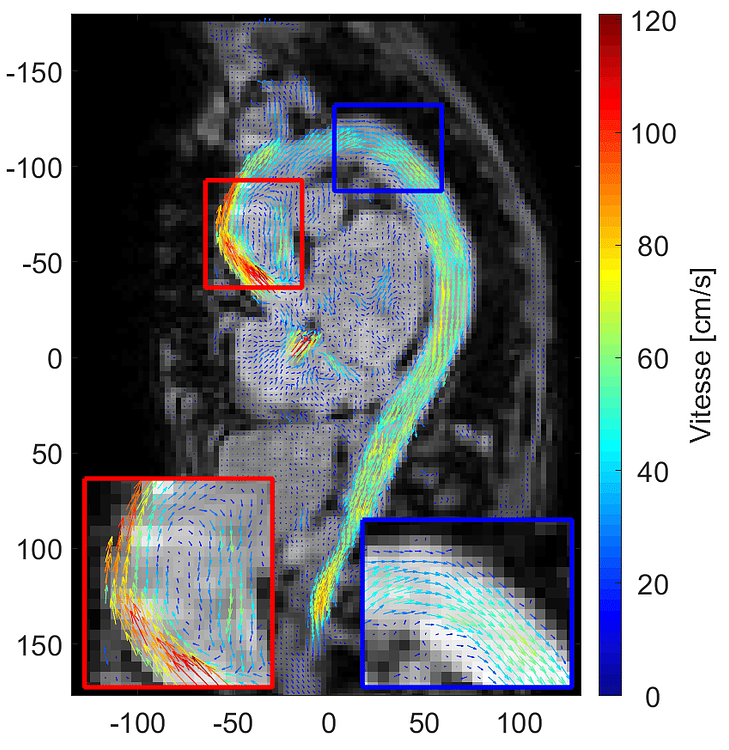
Ce procédé repose sur un principe simple mais puissant : si l’on connaît la manière dont les molécules se déplacent, on peut en déduire la manière dont circule le liquide tout entier. Les images obtenues n’en sont pas réellement au sens photographique, mais des cartes de vecteurs : de petites flèches indiquant la direction du flux, comme illustrées sur la Figure 1. Assemblées, elles racontent une histoire : celle du sang qui s’accélère, ralentit, s’oriente, se dévie, parfois tourbillonne.
Figure 1 – Représentation du système cardiovasculaire thoracique par IRM de flux 4D avec le signal anatomique en nuance de gris et chaque vecteur vitesse coloré suivant son intensité.
Cette représentation est précieuse pour comprendre les pathologies cardiovasculaires. Le flux sanguin n’est pas un simple transporteur passif ; il exerce des forces sur les parois des vaisseaux, influence la santé des cellules qui les composent, et participe à l’évolution de maladies comme l’athérosclérose ou certains anévrismes. Pouvoir l’examiner directement, sans chirurgie ni sonde invasive, constitue donc une possibilité remarquable.
Alors pourquoi n’est-ce pas encore utilisé dans tous les hôpitaux ?
Là réside le paradoxe : la technologie existe, mais son usage en routine demeure rare en 4 dimensions. Plusieurs raisons expliquent cette situation, et elles illustrent à quel point l’imagerie médicale est un équilibre fragile entre “ce qu’on pourrait faire” et “ce qui est réellement faisable dans un contexte clinique”.
La première limite tient au temps d’acquisition. Pour enregistrer un volume complet en 3D et mesurer la vitesse en chaque point, il faut multiplier les points de mesure. Un examen d’IRM de flux 4D peut ainsi durer entre dix et vingt minutes, parfois davantage. C’est très long pour un hôpital où chaque minute d’IRM compte, surtout face à des demandes toujours croissantes. Les services qui souhaiterait intégrer cette séquence d’acquisition se trouverait face à un choix : sacrifier du temps d’examen standard ou limiter la technologie à quelques patients spécifiques.
Une deuxième contrainte concerne la résolution spatiale. Pour ne pas dépasser des durées d’acquisition raisonnables, les images sont souvent prises avec des voxels (des “pixels en 3D”) relativement gros. Cela fonctionne bien pour les grandes artères, mais complique l’analyse de zones plus petites ou de phénomènes très localisés. Les bords des vaisseaux deviennent flous, et les mesures sensibles près de la paroi perdent en précision.
À cela s’ajoutent les artefacts et le bruit inhérents à l’IRM. Le signal utilisé pour mesurer la vitesse est faible, particulièrement dans les régions où le sang circule lentement et lorsque les structures anatomiques sont complexes. Les variations de vitesse peuvent alors être masquées ou, au contraire, exagérées, ce qui complique l’interprétation.
Enfin, le post-traitement des données constitue une étape cruciale mais encore lourde. Une fois les signaux acquis, il faut les reconstruire, corriger les décalages, stabiliser les vitesses, et parfois combler des zones mal mesurées. Ce travail est indispensable pour obtenir des cartes de flux homogènes et interprétables, mais il demande du temps, de la rigueur et parfois des outils de calcul encore réservés à la recherche.
Ce que l’on peut apprendre : le cisaillement pariétal, ou comment le flux modifie nos cellules
Parmi les informations que l’on peut extraire des images d’IRM de flux 4D, l’une des plus intéressantes est le cisaillement pariétal, appelé wall shear stress en anglais. Il s’agit d’une force mécanique qui naît lorsque le sang frotte contre la paroi du vaisseau. Bien qu’elle soit invisible à l’œil nu, cette force joue un rôle déterminant dans la santé vasculaire : les cellules endothéliales, qui forment la surface interne du vaisseau, y sont extrêmement sensibles. Elles perçoivent ces forces : selon l’intensité et la direction du flux, elles modifient leur forme, leurs connexions et leur activité, car la paroi vasculaire transforme ces contraintes en signaux qui orientent le comportement cellulaire.
Lorsque le cisaillement est stable et modéré, les cellules adoptent une forme allongée et orientée dans le sens du flux, ce qui favorise un environnement vasculaire sain permettant une certaine élasticité des tissus (Figure 2). Mais dans les zones où le flux devient chaotique, ou au contraire trop faible, les cellules réagissent différemment : elles se déforment, s’activent, produisent des signaux biologiques qui peuvent, à long terme, favoriser la formation de plaques d’athérosclérose ou d’autres anomalies.
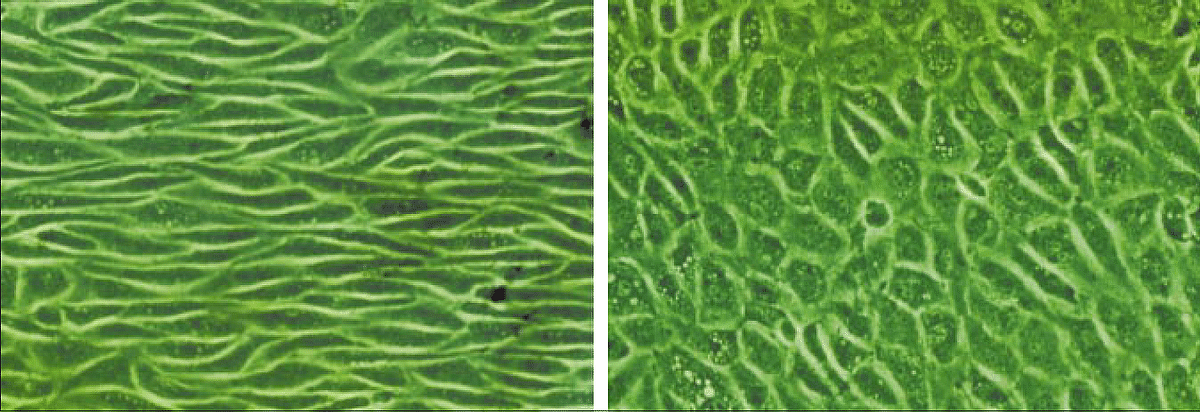
Figure 2 – Représentation des cellules endothéliales d’un bovin après la soumission à un cisaillement à la paroi physiologique à gauche et un faible cisaillement à la paroi à droite (image extraite de [1]).
Cependant, estimer correctement le cisaillement pariétal nécessite une excellente précision et résolution dans la mesure des vitesses, notamment très près de la paroi — un domaine où l’IRM de flux 4D souffre encore de limitations. D’où l’importance d’améliorer les méthodes de reconstruction.
Relever les défis : comment la recherche cherche à améliorer ces images
Pour exploiter pleinement le potentiel de l’IRM de flux 4D, les chercheurs doivent résoudre un ensemble de problèmes où se rencontrent physique, mathématiques et informatique. Une grande partie du travail consiste à reconstituer des informations plus fines à partir d’images imparfaites, et à tirer tout ce que l’on peut d’un signal limité.
L’un des axes les plus explorés concerne la super-résolution, un domaine où l’on tente de recréer des détails plus nets que ceux capturés par l’acquisition initiale. L’idée n’est pas de “deviner” une image au hasard, mais de s’appuyer sur des modèles physiques et des observations cohérentes pour produire une version plus détaillée du flux (voir Figure 3). Cela permet d’améliorer la précision des mesures près de la paroi sans allonger le temps d’examen.
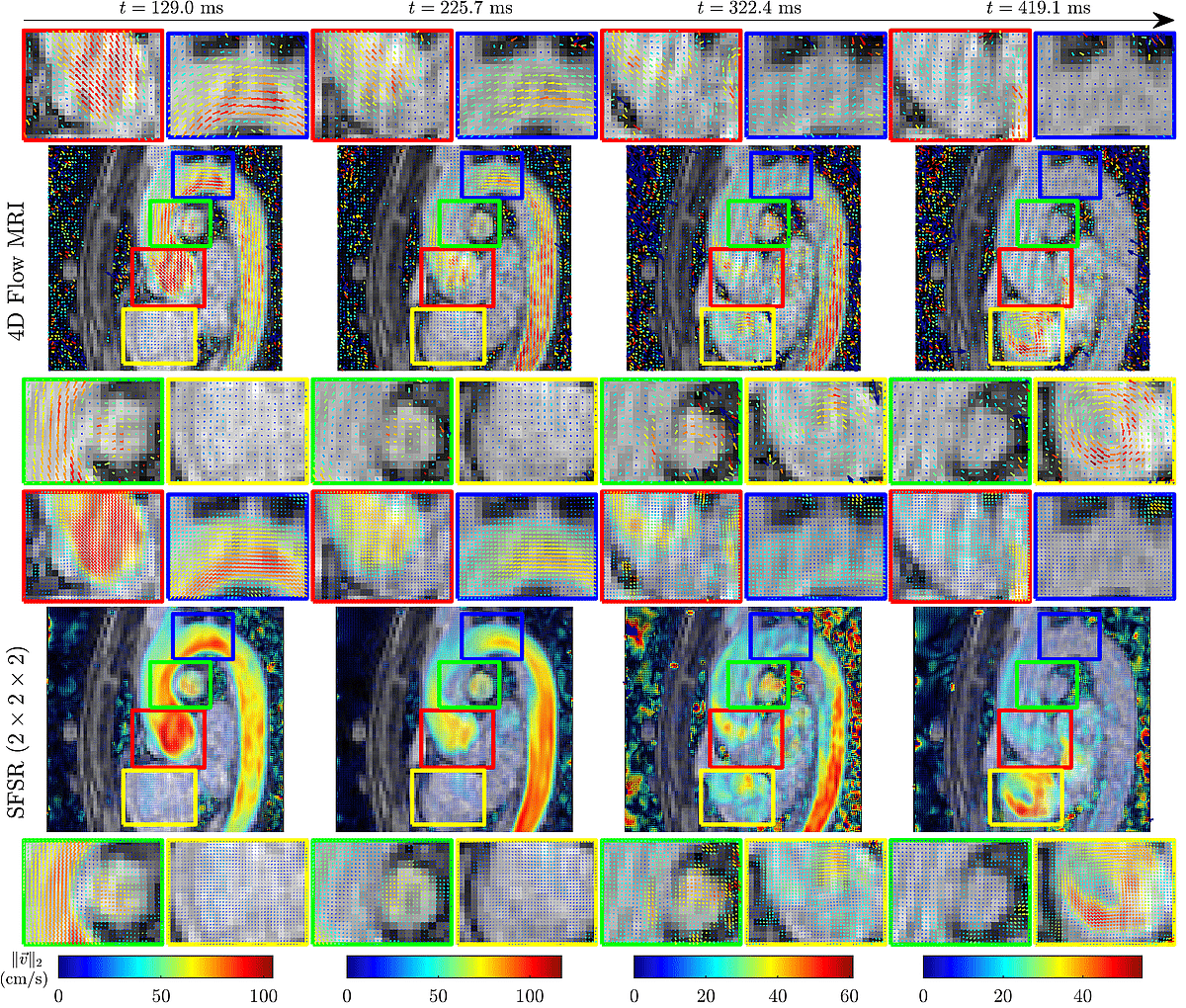
Figure 3 – Représentation de données d’IRM de flux 4D pour différents moments du cycle cardiaque sur le premier bandeau et la version super-résolue obtenue avec l’algorithme SFSR [2].
Un autre défi consiste à réduire le bruit présent dans les données. Certaines méthodes imposent des contraintes inspirées de la mécanique des fluides, par exemple le fait que le sang soit incompressible, c’est-à-dire qu’il ne peut pas se “condenser” ou “gonfler” localement. Intégrer cette contrainte dans les algorithmes permet de stabiliser les cartes de vitesse et d’éliminer certaines fluctuations artificielles.
Enfin, de nombreuses équipes de recherche, dont notamment l’équipe IPI (Image Perception Interaction) du Laboratoire des Sciences du Numérique de Nantes, explorent les potentialités des modèles d’intelligence artificielle. L’IA peut apprendre à repérer des motifs récurrents dans les images, à corriger les erreurs de mesure, à reconstruire des champs de vitesse plus cohérents ou à segmenter des zones d’intérêts dans le volume. Ces travaux permettent d’automatiser et ainsi de rendre exploitable la masse d’informations contenue dans les données d’IRM de flux 4D. Par ailleurs, l’un des enjeux majeurs est de combiner ces modèles avec des connaissances physiques solides pour éviter qu’ils ne fabriquent des données irréalistes, ce qui pourrait être dommageable pour le diagnostique d’un patient. Cette approche hybride, mêlant IA et contraintes issues de la mécanique des fluides, semble aujourd’hui l’une des voies les plus prometteuses.
Une technologie d’avenir, mais une évolution progressive
L’IRM de flux 4D n’est pas encore prête à devenir une routine clinique, et il est important de ne pas promettre un changement immédiat. Pourtant, chaque amélioration dans les méthodes d’acquisition et de reconstruction contribue à rapprocher cette technologie d’un usage plus large ; notamment au travers de transferts technologiques avec les industriels de l’imagerie médicale. Ce travail, souvent discret et patient, construit les fondations de l’imagerie de demain : une imagerie plus dynamique, plus riche en informations, et peut-être capable un jour d’identifier des anomalies avant même l’apparition des symptômes.
Dans un contexte où les maladies cardiovasculaires restent la première cause de mortalité dans le monde, comprendre comment le sang circule n’est pas un luxe scientifique, mais une nécessité. En rendant visibles les forces qui agissent sur nos vaisseaux, en révélant les zones de stress ou de vulnérabilité, l’IRM de flux 4D pourrait devenir une alliée précieuse pour la prévention.
Le chemin est encore long, mais chaque avancée — qu’elle vienne d’un modèle physique amélioré ou d’un nouveau réseau de neurones — renforce notre capacité à “voir” le système cardiovasculaire autrement. C’est ce qui rend cette technologie aussi passionnante : elle se trouve à la frontière entre la biologie, la physique et le numérique, et son véritable potentiel reste encore à déployer.
Références
[1] Malek, A. M., Alper, S. L., & Izumo, S. Hemodynamic shear stress and its role in atherosclerosis. Journal of American Medical Association, 282(21) : 2035–2042, 1999.
[2] Levilly, S., Moussaoui S., & Serfaty, J.-M. Segmentation-Free Velocity Field Super-Resolution on 4D Flow MRI. IEEE Transactions on Image Processing, 33 : 5637-5649, 2024.