La technologie qui révolutionne la détection du cancer
Publié par Nantes Université, le 23 octobre 2025 630
Un travail de recherche nantais pose les bases d’une nouvelle perspective de médecine personnalisée améliorant le diagnostic précoce des cancers.
Le corps humain est un système très complexe composé de près de 15000 milliards de cellules qui se divisent, meurent et se renouvellent continuellement au cours de la vie. Généralement, les cellules sont programmées pour s’autodétruire lorsqu’elles présentent des défauts. Cependant, certaines pathologies surviennent lorsque les cellules malades se divisent de manière incontrôlable, sans tenir compte des signaux qui contrôlent leur mort et ces cellules deviennent ainsi immortelles [1].
Le cancer est le nom d’un groupe de pathologies dans lesquelles les cellules rebelles se divisent d’une manière incontrôlable, affectant n’importe quelle partie du corps. Le terme « cancer » vient du mot grec « karkinos », signifiant crabe, inventé par Hippocrate en raison de sa ressemblance avec le crustacé. Il existe diverses théories expliquant cette ressemblance, notamment la dureté de sa coquille, la douleur provoquée par ses pincements, le caractère « agrippant » du cancer aux tissus, et la tendance de certaines tumeurs à se propager à d’autres organes, similaire aux pattes d’un crabe [2]. Les cellules cancéreuses appelées aussi cellules « malignes » présentent donc des altérations qui modifient leur comportement et plus particulièrement leur croissance incontrôlée et leur capacité à se déplacer dans le corps. Ces cellules sont responsables de la formation de tumeurs « malignes » (cancéreuses) et non de tumeurs « bénignes » qui, bien qu'elles présentent également une croissance incontrôlée, ne présentent pas d’altérations de leur morphologie, ne migrent pas sur de longues distances et n’induisent pas de foyers tumoraux dans d’autres organes. Les tumeurs bénignes ne nécessitent donc pas le même traitement que les tumeurs malignes.
Le cancer est une des principales causes de décès dans le monde. Selon l’Organisation Mondiale de la Santé, près de dix millions de décès en 2020 étaient dus au cancer. Les cancers du sein, de la prostate, du poumon, du côlon, du rectum sont les plus fréquents. Le développement d'un cancer est généralement associé à la présence d’une ou de plusieurs mutations de gènes contrôlant la biologie des cellules ou à des altérations des programmes moléculaires qui contrôlent l’expression des gènes (« épigénétique »). L’origine des cancers est multiple et inclut des facteurs environnementaux, (l'exposition au soleil, la consommation de tabac ou d'alcool, la présence de polluants, l'alimentation, etc.) mais aussi des facteurs transmissibles de génération en génération, telles que des mutations portées par certains gènes [3]. Dans ce dernier cas, on parle souvent de prédisposition génétique au cancer qui correspond à un risque accru de développer la maladie mais qui n’est en aucune manière associée à un développement systématique de celle-ci. Lorsque le cancer est déjà établi, tout comme la ténacité et la résistance du crabe , il se caractérise par la croissance rapide de cellules anormales au-delà des limites habituelles. Il peut ainsi envahir des parties éloignées de notre corps par un processus appelé métastase. Au cours de ce processus de métastase ou de dissémination, un groupe sélectionné de cellules cancéreuses (« malignes ») provenant de la tumeur d'origine, appelées « circulantes », pénètre dans le système sanguin et circule dans l'organisme [4]. Ces cellules « circulantes » cherchent à trouver un lieu dans un organe localisé à une distance qui leur est le plus favorable pour s’y arrêter et s’y multiplier [5]. Le processus de métastase rend le traitement du cancer plus difficile car est souvent associé à des mécanismes de résistance aux traitements [6].
Au cours de la dernière décennie, des efforts considérables ont été déployés pour détecter précocement l'apparition d'un cancer et faciliter son suivi à partir d'un échantillon sanguin. Ces approches sont appelées « biopsies liquides ». Ces biopsies permettent d'analyser et d'identifier les marqueurs biologiques du cancer de manière peu invasive, tout en facilitant le suivi de l'évolution de la maladie et l'efficacité du traitement. Elles permettent donc d'obtenir des informations précieuses sur le diagnostic, le pronostic et le suivi thérapeutique [4][7]. Bien que cet examen commence par le simple prélèvement d’un échantillon de sang, le processus de détection et d'isolement de ces cellules représente un véritable défi technologique en raison de la faible présence dans le sang des cellules cancéreuses (souvent moins de 20 cellules pour 10 millilitres).
Pour permettre l’isolement des cellules rares dans le sang, les techniques dîtes « microfluidiques » se sont développées. La microfluidique est devenue une technologie prometteuse en recherche biomédicale en raison de sa capacité à manipuler de minuscules volumes de fluides avec une grande précision [8]. L’utilisation de techniques microfluidiques dans la détection de cellules cancéreuses circulantes présente de nombreux avantages par rapport aux méthodes traditionnelles parmi lesquels :
- la capacité de détecter au moins 1 cellule circulante dans 10 millilitres de sang,
- un risque moindre de perte de cellules,
- un processus d'isolement plus rapide.
Ces techniques sont des outils indispensables pour la détection précoce de l’initiation et de la récidive de la maladie, et pour l’aide aux choix thérapeutiques. Ces techniques font partie des outils qui permettent de définir la meilleure stratégie thérapeutique pour chaque patient et s’intègre dans des approches appelées médecine de précision.

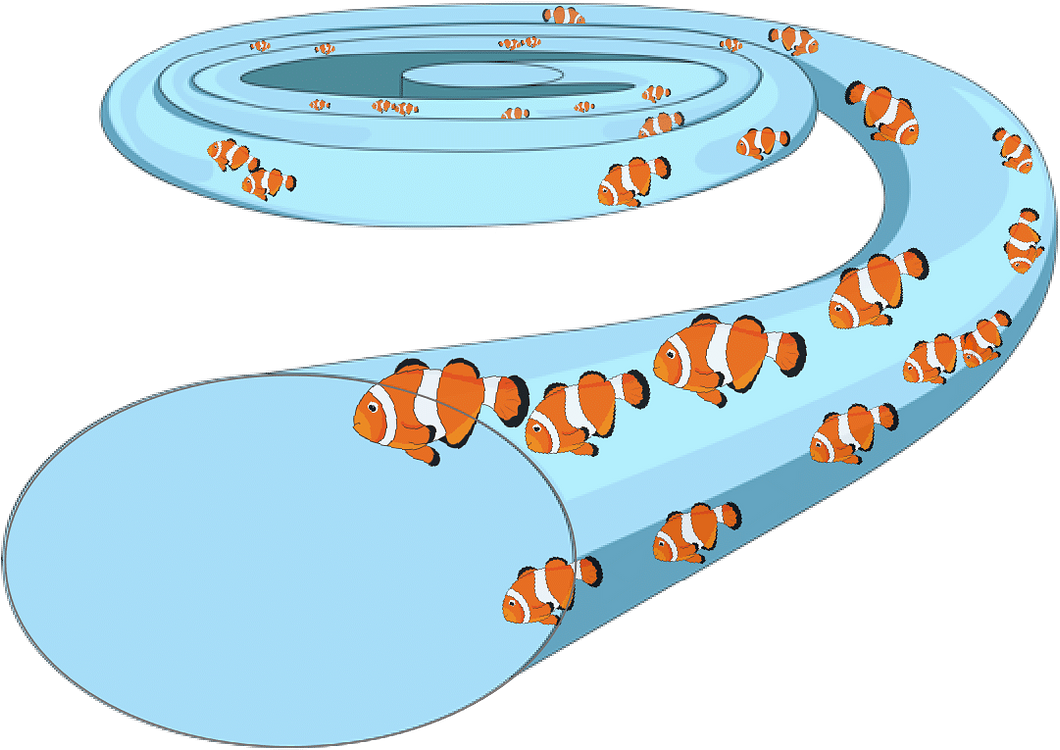
Pour comprendre comment les systèmes microfluidiques peuvent isoler des cellules dans de petits volumes de liquide, imaginez qu'une rivière coule dans notre corps, dans laquelle circule le sang.
Imaginez que, dans le sang d'un patient, les poissons représentent des cellules cancéreuses qui nagent dans cette rivière. Pour capturer ces poissons, nous avons recours aux lois de la physique. Tout comme dans le courant australien montré dans le film « Le Monde de Nemo », la force de l'eau crée un tourbillon et forme une spirale dans laquelle nagent des poissons de différentes tailles et formes. Mais voici ce qui est intéressant : comme les poissons sont de tailles différentes, certains sont plus affectés par le courant que d'autres. Les plus gros poissons ont plus de mal à nager à contre-courant et ont tendance à être poussés vers les côtés du canal, où le courant est plus lent. A l'inverse, les plus petits poissons peuvent être facilement entraînés par le courant vers le centre du tourbillon, où le courant est plus rapide. Dans ce tourbillon, la force du courant océanique organise la position des poissons en fonction de leur taille dans différentes parties du tourbillon. De la même manière, dans un canal microfluidique courbé, les cellules sont soumises aux mêmes forces, ce qui provoque leur séparation en fonction de leur taille [9][10]. Par cette approche, nous pouvons trier les poissons dans l’océan en fonction de leur taille grâce à la force du courant océanique !

Grâce à cette organisation par taille, nous avons la possibilité de « récolter » les cellules qui nous intéressent. En collaboration avec la Région des Pays de la Loire, l’Institut de Cancérologie de l’Ouest et Nantes Université, le laboratoire d'Hétérogénéité Tumorale et de Médecine de Précision développe un système microfluidique basé sur ce concept. L'objectif est d'utiliser ce système miniature en forme de spirale pour, collecter les cellules cancéreuses migrantes à partir d'un échantillon de sang et ceci afin de les identifier. Ce système microfluidique est efficace et ne nécessite pas de matériel volumineux ou coûteux. L'application de cet outil en clinique pourrait réduire le temps de diagnostic à moins de deux heures et augmenter la sensibilité de détection de 25 % par rapport aux méthodes actuelles. Ainsi, à partir d'un simple échantillon de sang, ce système permettrait de détecter le développement de métastases à un stade précoce. Imaginez un monde où le cancer pourrait être détecté avant même d'apparaître, grâce à un simple prélèvement sanguin qui en plus permettrait de suivre l'efficacité d'un traitement. Ce monde est en train de voir le jour.
Le domaine de la microfluidique en oncologie est un domaine multidisciplinaire faisant appel à diverses spécialités scientifiques (biologie, physique, chimie) qui allient leur effort pour répondre à un besoin médical. La révolution de la médecine personnalisée a déjà commencé !
Article rédigé par Isidora Panez-Toro, Doctorante à Nantes Université soutenue par la Région des Pays de la Loire et l’Institut de Cancérologie de l’Ouest. Unité en Sciences Biologiques et Biotechnologiques (US2B), CNRS, UMR6286 (Nantes Université) Encadrants : Pr Dominique Heymann, Dr Javier Muñoz-Garcia
Références
[1] Peng F, Liao M, Qin R, Zhu S, Peng C, Fu L, et al. Regulated cell death (RCD) in cancer: key pathways and targeted therapies. Signal Transduct Target Ther. 2022 Aug 13;7:286.
[2] Hajdu SI. A note from history: Landmarks in history of cancer, part 1. Cancer. 2011;117(5):1097–102.
[3] Weeden CE, Hill W, Lim EL, Grönroos E, Swanton C. Impact of risk factors on early cancer evolution. Cell. 2023 Apr 13;186(8):1541–63.
[4] Mu H, Zuo D, Chen J, Liu Z, Wang Z, Yang L, et al. Detection and surveillance of circulating tumor cells in osteosarcoma for predicting therapy response and prognosis. Cancer Biol Med. 2022 Sep 15;19(9):1397–409.
[5] Riggi N, Aguet M, Stamenkovic I. Cancer Metastasis: A Reappraisal of Its Underlying Mechanisms and Their Relevance to Treatment. Annu Rev Pathol. 2018 Jan 24;13:117–40.
[6] Ring A, Nguyen-Sträuli BD, Wicki A, Aceto N. Biology, vulnerabilities and clinical applications of circulating tumour cells. Nat Rev Cancer. 2023 Feb;23(2):95–111.
[7] Li W, Liu JB, Hou LK, Yu F, Zhang J, Wu W, et al. Liquid biopsy in lung cancer: significance in diagnostics, prediction, and treatment monitoring. Mol Cancer. 2022 Jan 20;21(1):25.
[8] Cai S, Deng Y, Wang Z, Zhu J, Huang C, Du L, et al. Development and clinical validation of a microfluidic-based platform for CTC enrichment and downstream molecular analysis. Front Oncol. 2023 Oct 2;13:1238332.
[9] Huang D, Man J, Jiang D, Zhao J, Xiang N. Inertial microfluidics: Recent advances. ELECTROPHORESIS. 2020;41(24):2166–87.
[10] Martel JM, Toner M. Inertial Focusing in Microfluidics. Annu Rev Biomed Eng. 2014 Jul 11;16:371–96.