Fabriquer un organe en laboratoire : le pari de la bio-impression
Publié par Nantes Université, le 10 juillet 2025 1.3k
Article écrit par Emmaëlle Carrot, doctorante au laboratoire RMeS (Inserm, Nantes Université)
Dans un petit village au cœur du Laos, un potier est en train de confectionner une nouvelle pièce. Sa manière de faire est plutôt surprenante, au lieu de modeler son vase à partir d’un bloc d’argile, ce potier ajoute de l’argile couche par couche, jusqu’à obtenir sa pièce finale. De cette manière, il peut fabriquer des objets de grande dimension tout en minimisant la perte en matière première. Ce même principe, lorsqu’il est automatisé, devient ce que l’on appelle la fabrication additive, ou plus simplement, l’impression 3D. Cette technologie a déjà révolutionné les chaînes de production de pièces sur-mesure, mais son champ d’action ne s’arrête pas à l’industrie : elle commence aussi à bouleverser le domaine de la santé.
L’impression 3D au service de la santé
Imaginez que l’on vous diagnostique une insuffisance rénale et que vous ayez besoin d’une greffe. Combien de temps vous faudra-t-il attendre ? Des mois, parfois des années, selon la disponibilité des donneurs. Et ce délai peut être critique pour de nombreux patients. Et si l’on pouvait réduire ce temps d’attente… en imprimant votre rein de toutes pièces ? Depuis plusieurs années, les chercheurs travaillent à adapter l’impression 3D au domaine de la santé. Cette approche a même un nom : la bio-impression 3D. L’argile serait remplacée par un matériau compatible avec le corps humain (appelé biomatériau), contenant éventuellement des cellules du patient. Et l’objet imprimé n’est plus un simple vase, mais un tissu biologique vivant, voire un organe fonctionnel. L’intérêt est immense : des implants sur mesure, un risque de rejet réduit grâce à l’utilisation des propres cellules du patient, et un espoir de raccourcir les listes d’attente. Alors bien sûr, on ne sait pas encore imprimer des reins totalement fonctionnels, mais les avancées sont spectaculaires.

Pourquoi ne pas utiliser la bio-impression pour faire avancer la recherche elle-même ?
Car après tout, si l’on peut fabriquer des organes humains pour envisager de les greffer, pourquoi ne pas s’en servir pour tester de nouveaux traitements ? On parle ici de concevoir des modèles imitant le vivant, dit biomimétiques, qui pourraient, à terme, permettre de limiter le recours à l’expérimentation animale en phase préclinique, et ainsi réduire le nombre d’animaux sacrifiés à des fins expérimentales mais aussi le coût des études. Et c’est justement dans cette perspective que s’inscrit mon sujet de thèse. Mon organe de prédilection est le disque intervertébral. Cet organe, de seulement quelques millimètres d’épaisseur, est localisé entre chacune de nos vertèbres. Il nous permet de bouger en souplesse et absorbe les chocs lorsque l’on marche, saute ou soulève une charge. Malheureusement, avec l’âge ou certains efforts répétés, ces disques s’usent. Et quand ils ne remplissent plus leur rôle d’amortisseur, les douleurs apparaissent.
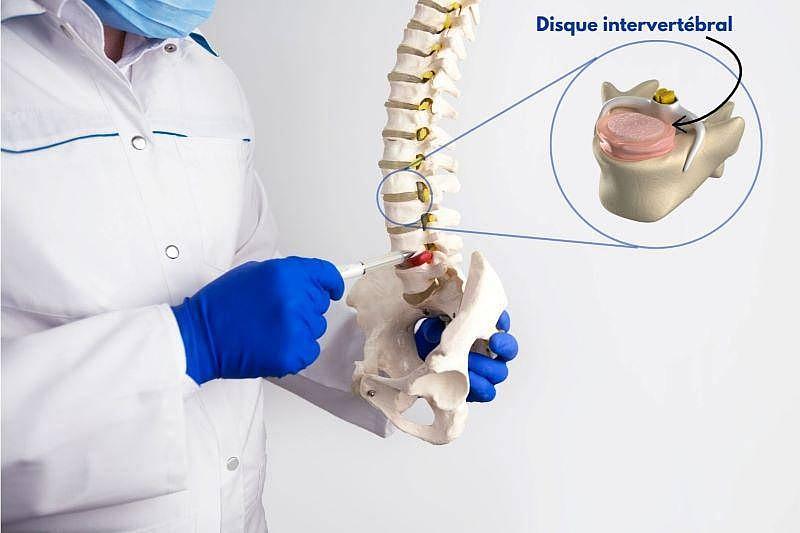
Dans mon laboratoire, au sein de Nantes Université[i], de l’Inserm et d’Oniris, les chercheurs travaillent activement à développer des thérapies innovantes pour soulager ces douleurs. Mon rôle, à moi ? Concevoir une réplique bio-imprimée du disque intervertébral, pour pouvoir y tester ces nouvelles thérapies. Grâce à la bio-impression, je peux placer précisément les cellules et les biomatériaux à l’endroit voulu, couche après couche, comme le potier au Laos… mais à une échelle microscopique. Une tâche impossible à réaliser à la main, car à cette échelle, il faudrait une vue digne d’un microscope ! Mais avant de pouvoir tenir cette réplique dans mes mains, j’ai été confrontée aux mêmes problématiques que dans le domaine de la transplantation : comment définir un disque intervertébral ? Et comment reproduire cette toute petite structure, qui est en réalité bien plus qu’un simple amortisseur de chocs ?
La définition d’un organe : plus complexe qu’on ne l’imagine
Peut-on vraiment “reproduire” un organe ? Cela semble simple : prendre sa forme, ses cellules, et les imprimer ensemble. Mais en réalité, c’est bien plus subtil. Un organe n’est pas un objet inerte. C’est un système vivant, dynamique, composé de tissus qui interagissent entre eux, réagissent aux contraintes mécaniques, échangent des signaux chimiques, évoluent dans le temps. Pour fabriquer un bon modèle, il faut donc se poser beaucoup de questions : Quelles cellules choisir ? Dans quelle organisation ? Quel biomatériau utiliser ? Comment reproduire le comportement mécanique du vrai tissu ? Le modèle est-il stable dans le temps ? Reproduit-il les réactions biologiques que l’on souhaite étudier ? Comment l’évaluer ?
Ce sont ces questions qui font de la bio-impression un défi passionnant. Et dans ce puzzle multidisciplinaire, chacun a son rôle : biologistes, ingénieurs, spécialistes des matériaux. Car concevoir un modèle fidèle, ce n’est pas simplement imprimer un “organe en plastique” vivant : c’est tenter de comprendre comment le vivant fonctionne, pour mieux l’imiter.
Ma thèse a donc été guidée par toutes ces questions, et après 3 ans, la première génération de modèles bio-imprimés de disque intervertébral est là. Le modèle reproduit l’architecture globale du disque intervertébral, à savoir sa taille, sa forme et son organisation cellulaire. Le modèle est stable en culture pendant 1 mois ce qui très encourageant pour la suite. Ces résultats font ainsi l’objet d’un article scientifique[ii] soumis dans une revue internationale, dans lequel est présentée la démarche qui a été mise en place pour obtenir ce modèle. Bien sûr de nombreuses questions restent en suspens, mais s’il n’y avait plus de questions… où serait la recherche ?
Article écrit par Emmaëlle Carrot, doctorante au laboratoire RMeS (Régénérative Medicine for Skeleton – Inserm, Nantes Université), sous la direction de Catherine Le Visage, Jérôme Guicheux et Vianney Delplace. Les trois années de thèse de Emmaëlle Carrot ont été financées par une allocation doctorale de la Région Pays de la Loire (50%) et par le projet iPSpine du programme de recherche et d'innovation Horizon 2020 de l'Union européenne (50%).
[i] Inserm U1229, Médecine Régénératrice et Squelette (https://rmes.univ-nantes.fr/)